卢源达,钟巧芳,王 波,张敦宇,殷富有,王玲仙,程在全,陈 玲
(1.云南省农业科学院 生物技术与种质资源研究所,云南省农业生物技术重点实验室,农业部西南作物基因资源与种质创制重点实验室,云南 昆明 650205;2.云南农业大学 植物保护学院,云南 昆明 650224)
稻黄单胞杆菌(Xanthomonasoryzaepv.oryzae,Xoo)可在水稻的各个生长阶段进行为害,是造成水稻白叶枯病(Bacterial blight,BB)的元凶。一般情况下,该病害能致使水稻产量减少10%~20%,环境适宜时,可致水稻减产一半或绝收[1-2]。Xoo的Ⅲ型分泌系统(Type Ⅲ secretion systems,T3SSs)能够分泌转录激活效应子(Translation activator-like effector,TALE)和非类转录激活效应子(Non-translation activator-like effector,non-TALE)[3-4],当效应子进入水稻细胞后会激活或抑制水稻的免疫系统,进而导致水稻抗、感差异的表型产生[5],其中TALEs是其主要的致病因子。与此同时,Xoo菌株能够在短时间内不断变异出强致病性的菌株,进而分泌出新的效应子来攻破水稻产生的抗性[6]。然而,在水稻与Xoo的博弈中,水稻也进化出许多白叶枯病抗性基因(Xa),如:NLR、SWEET、TFIIAγ和Executor类的抗性基因[7-8]。
水稻是世界上一半人口以上的口粮作物。中国又是世界第一大水稻种植国,在长江以南的稻作区水稻白叶枯病频频发生,其余稻作区近年也有抬头趋势[9]。在水稻生产中,常使用化学防治的方法来防治水稻白叶枯病,其方法具有治标不治本的特点,并且极易造成环境污染。长期的育种实践证明,利用抗源(抗性基因R)培育抗性品种来防治水稻白叶枯病效果最佳。然而,野生稻被誉为植物中的大熊猫,优良性状刻在基因里。目前,已发现的抗白叶枯病基因约有1/4来自野生稻。其中,Xa23(Chr.11)、Xa30(Chr.11)、Xa47(t)a(Chr.11)供体材料是普通野生稻 (O.rufipogon),Xa45(t)(Chr.4)供体材料是一年生普通野生稻(O.nivara),Xa29(Chr.1)供体材料是药用野生稻(O.officinalis),xa32(Chr.12)供体材料是疣粒野生稻(O.meyeriana),还有Xa21(Chr.11)、Xa27(Chr.6)、Xa35(Chr.11)、Xa32(Chr.11)、Xa36(Chr.11)、xa41(Chr.11)等基因的供体材料来源于其他野生稻[10-12]。由此可见,野生稻中蕴含众多白叶枯病抗性基因。
相较于其他野生稻,普通野生稻与栽培稻关系最近,其蕴含的R基因更容易运用到栽培稻中[13]。元江普通野生稻(后续简称“YP”)作为亚洲栽培稻起源中心之一,蕴含宝贵的基因库,对其进行发掘和利用在农业生产上具有重大意义。因此,利用YP创制种质资源,进而应对不同Xoo生理小种的危害。本研究以元江普通野生稻、合系35及其渗入系后代L214和G252为研究材料,利用10个已报道并已克隆的抗水稻白叶枯病基因对供试材料进行功能标记筛选、同源克隆、序列分析和实时荧光定量PCR(qRT-PCR),进而明确这些材料中是否含有这些R基因的抗性同源基因,也为进一步的挖掘利用元江普通野生稻及其渗入系后代种质资源中的R基因奠定理论基础并提供技术参考。
选用元江普通野生稻(♂)、HX35(♀)、渗入系BC2F16材料L214(IL)和G252(IL)用于后期的DNA和RNA提取以及接菌鉴定;含有目标基因的IRBB1(Xa1)、IRBB3(Xa3/Xa26)、IRBB4(Xa4)、IRBB5(xa5)、IRBB7(Xa7)、IRBB10(Xa10)、IRBB13(xa13)、IRBB21(Xa21)、海南文昌普通野生稻(Xa23)、IRBB27(Xa27)用于后续基因鉴定的阳性对照材料;IR24(不含已克隆的白叶枯病抗性基因)用于后续基因鉴定的阴性对照材料。
所有水稻材料(YP、HX35、L214、G252)均种植于云南省农业科学院生物技术与种质资源研究所的人工气候室(光照16 h,黑暗10 h,温度23~28 ℃,相对湿度60%~100%)。采用剑叶剪叶的方法,对生长至孕穗期的供试水稻材料接9个不同生理小种的菌株(菌株信息详见表1),接种后温室培养条件下观察记录[14]。待病情稳定后15~21 d对其进行病害调查。抗性评价参照Yang等[15]的标准执行:病斑长度小于等于5 cm为抗病(R),>5 cm为感病(S)。
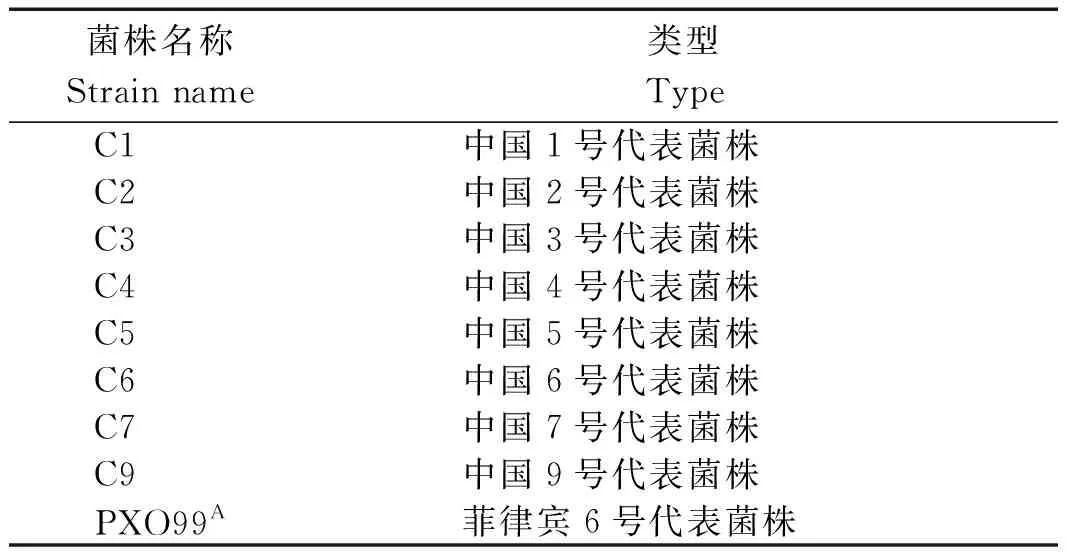
表1 9个Xoo菌株来源信息Tab.1 9 Xoo strains information sources
采用CTAB法提取植物基因组总DNA[16]。选用10个已克隆白叶枯病抗性基因的功能标记对YP、HX35、L214、G252进行分子鉴定。Xa1、Xa3/Xa26、Xa4、xa5、Xa7、Xa10、xa13、Xa21、Xa23、Xa27等10个基因的功能标记参照Zhao等[17]2021年已报道的序列。从NCBI(http://www.ncbi.nlm.nih.gov/)上下载Xa7、Xa10、Xa23基因的序列,并设计特异性引物克隆基因。具体引物信息见表2 。采用高保真酶2×Phanta@ Max Master Mix(南京诺唯赞生物科技有限公司,P525)进行PCR扩增,PCR反应体系和反应程序按其说明书进行。PCR扩增后取5 μL PCR产物使用1%~3%琼脂糖凝胶电泳(胶的浓度根据目的片段大小而定)中检测,用凝胶成像系统拍照,剩余PCR反应产物送昆明擎科生物科技有限公司进行测序。测序结果利用BioXM 2.7.1进行分析。

表2 本试验用到的引物Tab.2 Primers used in this experiment
取YP、HX35、L214、G252的种子至培养皿中进行保湿萌芽处理。待其萌发转至温室(28 ℃光照12 h/23 ℃黑暗8 h,湿度90%)中培养至水稻分蘖后期,进行接菌(PXO99A菌株)处理,于 0,24,48,72,96 h 对叶片进行取样,用液氮进行速冻后保存于-80 ℃超低温冰箱备用。
使用 Eastep®Super RNA LS1040 提取试剂盒(Promega)进行基因组总RNA提取。利用HiScript® Ⅲ RT SuperMix for qPCR(南京诺唯赞生物科技有限公司,P323-01)试剂盒将总RNA反转录成cDNA。利用 NCBI 在线引物设计工具,根据抗病基因的CDS序列,设计基因表达引物,具体扩增引物信息见表2。以Actin1作为内参基因,参照ChamQ Universal SYBR qPCR Master Mix(南京诺唯赞生物科技有限公司,Q711)进行反应体系的配比, qRT-PCR 扩增,扩增程序为:95 ℃预变性 30 s;95 ℃ 8 s,60 ℃ 30 s,40 个循环。使用 2-ΔΔCt方法计算基因的相对表达量,利用 Excel 和SPSS整理和分析数据,使用 GraphPad Prism 8.0软件作图。
用中国的1~7、9号生理小种代表菌株及菲律宾6号生理小种代表菌株PXO99A,在水稻分蘖后期进行接种,接种后15~21 d,以6 cm为抗感分界,结果显示,YP、L214和G252对供试的9个菌株表现出高抗且病斑度均小于2 cm,渗入系母本HX35则表现出高感且病斑长度均超过10 cm(图 1)。

图1 接种不同Xoo生理小种的表型Fig.1 Phenotypes of different Xoo races inoculated
利用10个已经克隆的水稻白叶枯病抗性基因(Xa1、Xa3/Xa26、Xa4、xa5、Xa7、Xa10、xa13、Xa21、Xa23和Xa27)的功能标记对YP、HX35、L214和G252进行检测,由表3和图2可知,YP中能扩增到Xa7、Xa10抗病条带,大小依次为275,540 bp;HX35能扩增到760 bp的Xa23抗病条带;L214均不含任何抗病条带;G252能扩增到275 bp的Xa7抗病条带和760 bp的Xa23抗病条带。为了进一步明确含有抗病功能标记材料中是否存在假阳性标记,根据Xa7、Xa10、Xa23基因的序列,设计特异性引物进行克隆相应基因,结果显示,YP中能扩增到Xa10的同源片段却不能扩增到Xa7和Xa23的同源片段;HX35、L214和G252中能扩增到Xa23的同源片段却不能扩增到Xa7和Xa10的同源片段(图2)。

表3 抗白叶枯病基因的等位标记/同源片段情况Tab.3 The presence of allelic markers/fragments of BB resistance genes
O.rufipogon.海南文昌普通野生稻。O.rufipogon.Hainan Wenchang common wild rice.图2 白叶枯病抗性基因的PCR鉴定Fig.2 Identification of resistance genes to bacterial blight by PCR
将YP中的Xa10抗病同源片段序列与IRBB10中的Xa10基因序列进行比对,结果显示,两者的CDS区域序列一致但EBEAvrXa10位点序列差异较大,鉴于隐性xa10基因的序列尚无报道,因此,可认为YP中含有Xa10的同源基因(图3)。Xa23与xa23的序列差异主要是在启动子区域,两者CDS区域序列一致。将含有抗病同源片段的3份供试材料HX35、L214、G252中的Xa23与已公布的Xa23(CBB23)/xa23(JG30)启动子序列比对,结果显示,供试材料与感病基因xa23的EBEAvrXa23序列一致,因此,可以认为HX35、L214、G252中含有感病基因xa23。值得注意的是HX35中的XA23与JG30中XA23的第4位和第56位氨基酸序列存在差异(图4,5)。

红色框区域的核苷酸序列分别代表Xa10基因启动子的EBEAvrXa10位点序列。The nucleotide sequences in the red box region represent the EBEAvrXa10 locus sequence of the Xa10 gene promoter,respectively.图3 Xa10 (YP)与Xa10 (IRBB10)的序列比对Fig.3 Sequence alignment of Xa10 (YP)and Xa10 (IRBB10)

红色框区域的核苷酸序列分别代表Xa23基因启动子的EBEAvrXa23位点序列。The nucleotide sequences in the red box region represent the EBEAvrXa23 locus sequence of the Xa23 gene promoter,respectively.图4 Xa23同源基因序列比对Fig.4 Represents the sequence alignment of Xa23 homologous allele

红色背景代表氨基酸序列的差异。Red background represents the difference of amino acid sequence.图5 XA23蛋白序列比对Fig.5 XA23 protein sequence alignment
为了进一步验证Xa10、Xa23是否在供试材料中发挥功能,于孕穗期对供试材料接PXO99A进行 5 个不同时间点胁迫处理,结果显示,在5个时间段目标基因皆未上调表达(图 6)。值得注意的是,YP、HX35、L214、G252中的免疫激活标志基因OsPR1a和OsPR10皆在0~48 h上调表达,48 h后逐渐下调表达(图6)。
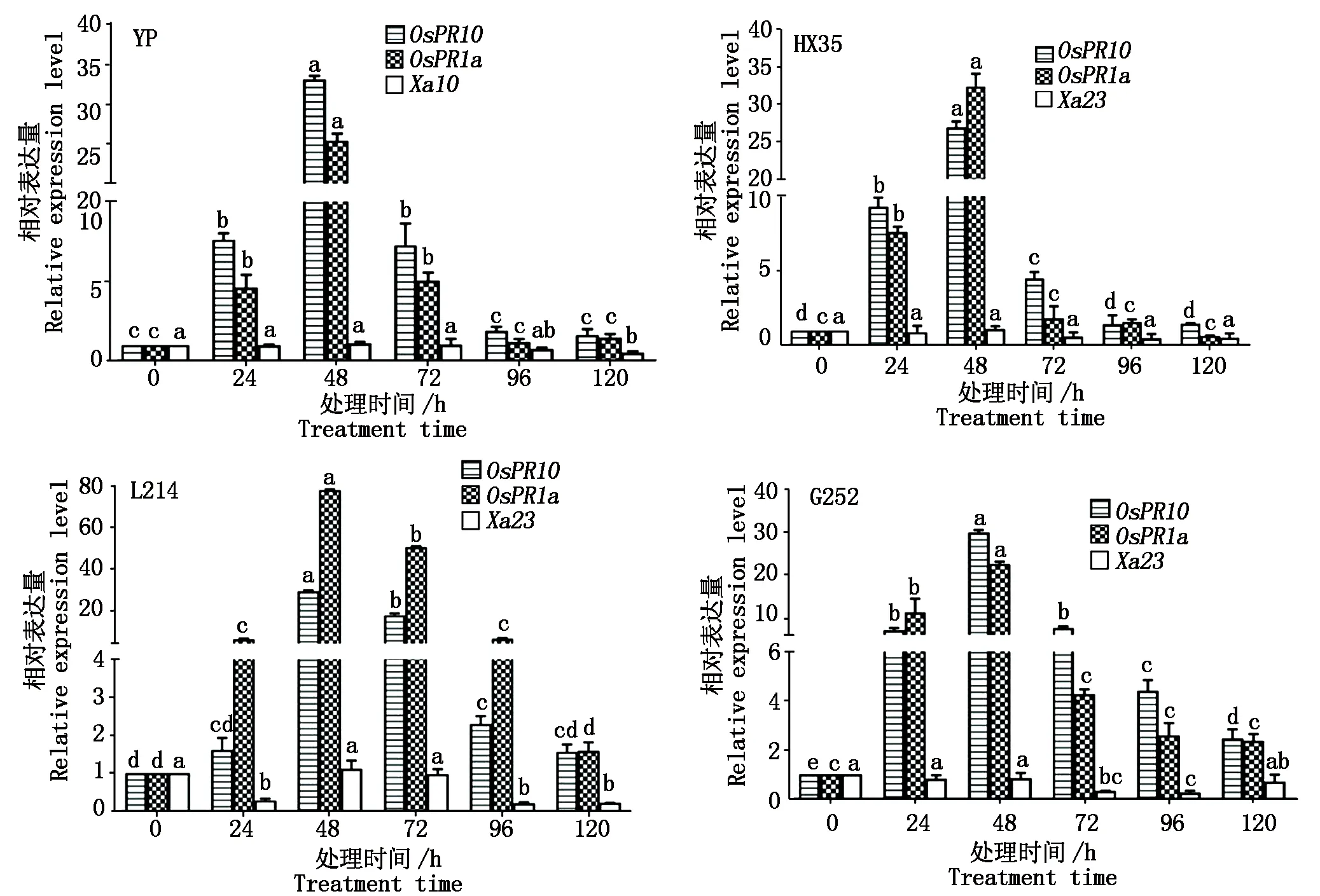
内参基因Actin1;不同小写字母表示差异显著(P<0.05)。The internal reference gene Actin1;Different lowercase letters indicate significant differences(P<0.05).图6 PXO99A 处理后Xa10和Xa23的表达分析Fig.6 Expression analysis of Xa10 and Xa23 under PXO99A treatment
元江普通野生稻与自然环境协同进化,但未有驯化痕迹[18-19]。本研究利用中国的8个不同生理小种和1个菲律宾生理小种接种元江普通野生稻及创制的渗入系后代L214和G252,发现YP、L214和G252对所有菌株表现出抗性。介于YP和现代栽培稻存在一定的生殖隔离,直接运用起来会有一定的困难,然而创制的渗入系后代可以突破这一难题。L214和G252拥有YP的血脉的同时还拥有对Xoo的广谱抗性,这些种质资源可用于后续的基因挖掘和抗病育种。
植物和病原菌这场军备赛从未停歇过,水稻和黄单胞杆菌的互作符合经典的基因对基因假说。应对不同致病性的Xoo生理小种出现,水稻也不断进化出新的R基因[20]。Xa7、Xa10、Xa23皆是Executor类的抗性基因,拥有较宽的抗菌谱[21]。本研究利用分子标记鉴定结合同源克隆的方法,发现HX35中含有Xa23的抗病同源片段,但其对所有供试菌株表现出感病,进一步的序列分析发现,HX35中的Xa23与xa23启动子的EBEAvrXa23序列一致,由此说明HX35中的Xa23是一个隐性感病基因。YP的分子标记检测结果显示,其可能含有Xa7、Xa10、Xa23的抗性同源基因,进一步的同源克隆发现其并未扩增到Xa7和Xa23,说明YP中不含有Xa7和Xa23。尽管YP分子标记和同源克隆皆检测到Xa10,但序列分析发现EBEAvrXa10位点核苷酸序列差异较大,不能判定YP中的Xa10是抗性基因,还有待进一步研究。值得注意的是渗入系后代L214在分子检测鉴定时并未检测到任何抗病同源片段,但其却对所有的供试菌株表现出抗性,说明该材料可能含有新基因。类似的是,渗入系后代G252中虽然分子标记检测到Xa7,但进一步的同源克隆却未克隆到Xa7,说明其不含有该基因。由此可见,Xa7、Xa10、Xa23基因的功能分子标记有待进一步的开发与利用。
Xa10、Xa23在水稻体内的表达受到Xoo体内对应的AvrXa10、AvrXa23蛋白的诱导表达,本研究用到的PXO99A菌株正好满足诱导表达的菌株要求[6,22]。结果显示,YP中的Xa10,HX35、L214、G252中的Xa23,均未受到PXO99A的诱导而表达。为证明诱导表达的成功,本研究利用2个免疫激活的标志基因OsPR1a和OsPR10来指示,结果显示YP、HX35、L214、G252的免疫反应皆被激活,由此说明这些基因在供试材料中不发挥功能,也在一定程度上说明了YP、L214和G252中可能含有新的R基因。
猜你喜欢叶枯病同源抗病两岸年味连根同源华人时刊(2023年1期)2023-03-14我国小麦基因组编辑抗病育种取得突破今日农业(2022年4期)2022-06-01以同源词看《诗经》的训释三则汉字汉语研究(2021年2期)2021-08-30“铤”有“直”义的词源学解释——兼说/直/义的同源词族汉字汉语研究(2019年2期)2019-08-27bZIP转录因子在植物激素介导的抗病抗逆途径中的作用浙江农业学报(2017年1期)2017-05-17葡萄新品种 优质又抗病新农业(2016年20期)2016-08-16虔诚书画乃同源河北书画研究(2016年3期)2016-04-28大蒜叶枯病重发原因分析与绿色防控技术上海蔬菜(2016年5期)2016-02-28水稻白叶枯病菌Ⅲ型效应物基因hpaF与毒力相关华南农业大学学报(2015年5期)2015-12-04苹果炭疽叶枯病在芮城县的发生特点及防治果树资源学报(2015年3期)2015-09-26扩展阅读文章
推荐阅读文章
明翰范文网 www.tealighting.com
Copyright © 2016-2024 . 明翰范文网 版权所有
Powered by 明翰范文网 © All Rights Reserved. 备案号:浙ICP备16031184号-2